CAR-T 免疫疗法在美国的研究进展和发展概况
CAR-T 免疫疗法 (Chimeric Antigen Receptor T-Cell Therapy)
2010年五月,家住美国宾州Hershey市的刚满五岁的女孩Emily Whitehead被确诊患急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)。当时她像很多同病患儿一样,在住处附近的Hershey Medical Center开始化疗。化疗一年半后复发。在以后的3个多月,Emily继续接受强化性化疗,为2012年二月份的骨髓移植做准备。ALL是一种常见的儿童癌症。虽然百分之八十五的ALL儿童在经过两年的标准化疗后有很好疗效,但是对于化疗耐药的儿童就没有其它有效治疗方法。Emily的复发证明她患的是那种抗药的ALL。
骨髓移植前两周,Emily再次复发。尽管医生用尽了各种化疗,都不能阻止病情恶化。2012年4月,Emily从当地医院转到了费城儿童医院(CHOP)。那里的医生告诉家长,因为两次化疗失败,可试用一种正在进行I期临床试验的新疗法。同时医生也告诉家长该疗法的高风险。Emily 的的父母,Tom 和Kari,考虑女儿病情继续恶化,表达了他们同意试一试新疗法的想法。这样,在费城儿童医院癌症中心,Emily正好符合实验性CAR-T细胞治疗,新的临床试验开始。
图1,CAR-T治疗前后的Emily

2012年4月17日,Emily成为第一个接受CAR-T细胞治疗的儿科患者。接受治疗三周后,她奇迹般恢复。CAR-T细胞治疗对Emily 完全有效。三个月和六个月后再次检查她的骨髓,骨髓里已查不到任何癌症细胞, 而且抗癌症CAR-T细胞仍然存活在她的体内。
对于Kari和Tom,不可思议的是,Emily在短短几个月内变化很大。经过治疗,她已能回到家,上学,踢足球和溜狗。她像任何其他小女孩一样, 可以正常生活。
图2,治疗后的Emily, 1 年,2 年,3 年,4 年,以及和前总统的照片。
CAR-T 细胞治疗为什么能创造奇迹,是由于科学家将T 淋巴细胞改装成能够识别和杀伤肿
瘤的T 淋巴细胞。 肿瘤免疫主要由细胞毒性T 细胞(CTL)介导。活化的T 淋巴细胞才能杀伤肿
瘤。当肿瘤细胞抗原递呈特异性信号,会被T 细胞表面受体(TCR)识别。TCR 可变区和抗原的相
互作用会引发与TCR 相连的CD3 的ζ亚基激活产生第一信号, T 淋巴细胞会有应答反应。仅有第
一信号引起T 淋巴细胞反应是不足以杀伤肿瘤的,需要有协同刺激信号如CD28 参与和激活所产
生的第二信号才能够引起有效的T 细胞反应。 两个信号都被激活是活化T 淋巴细胞,并且产生反
应的重要条件。
综上所述,T 细胞杀伤肿瘤是经过其TCR 识别肿瘤抗原,引发与TCR 相连的CD3 的ζ亚
基激活,同时在激活的协同刺激第二信号CD28 参与下,杀伤或/和消灭肿瘤细胞。肿瘤的形成是
由于种种原因,T 细胞不能识别肿瘤抗原,清除细胞,导至细胞无控制生长。除了CD28 外,还
有其它分子,如4-1BB, OX40 也充当正向协同刺激信号。
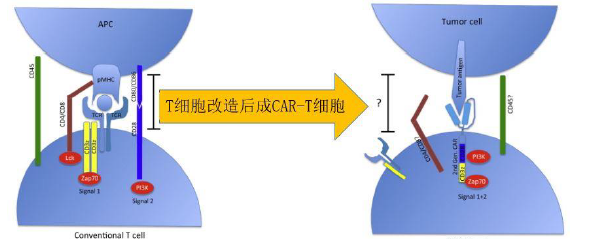
人为的针对肿瘤的靶点制备特异性抗体,然后利用基因工程技术将抗体具有结合功能的区
域替代T 细胞受体(TCR)的可变区,形式TCR 和抗体嵌合体(Chimeric Antigen Receptor,
CAR),利用病毒载体,加入到人体外的T 细胞,抗体能表达在T 细胞表面,这种含有嵌合抗体
的T 细胞叫CAR-T 细胞(CAR 加上 T 细胞)。当CAR-T 细胞输回到病人体内,抗体就能识别并特
异性结合肿瘤细胞上的靶点,激活T 细胞并使之杀死肿瘤细胞,达到治疗的目的。(图3)
图3, T 细胞两个激活信号,CAR将两个激活信号结合在一起。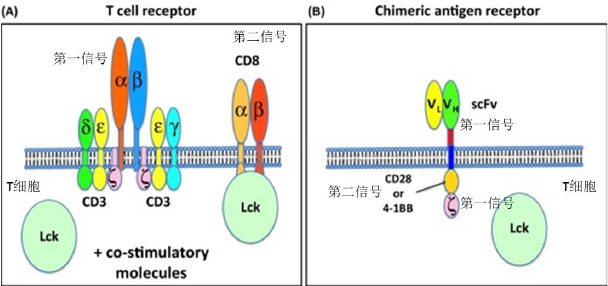
典型CAR的结构由胞外抗原结合区、跨膜区域和胞内信号转导区组成。其中胞外抗原结合区来源于单克隆抗体的单链抗体 (single chain fragment variable. scFv),单链抗体是由轻链 (VH) 和重链 (VL)通过连接而形成的。scFv是CAR结构里的第一个关键部位,它能识别肿瘤特异性抗原,即所说的靶点,比如CD19, EGFR等,而不是需要加工递呈出来的抗原多肽。因此这样的结构解决了两大问题:靶向性问题和绕开抗原递呈的问题。(图4,5)
图4,CAR-T细胞。
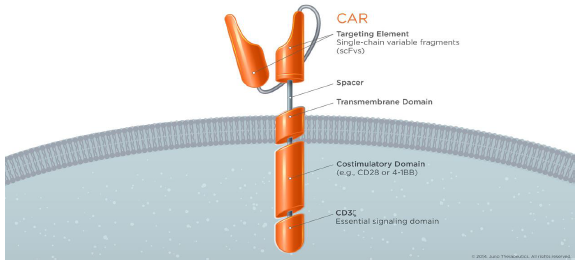
图5,TCR的部份被scFv替换,T细胞改造成CAR-T细胞。
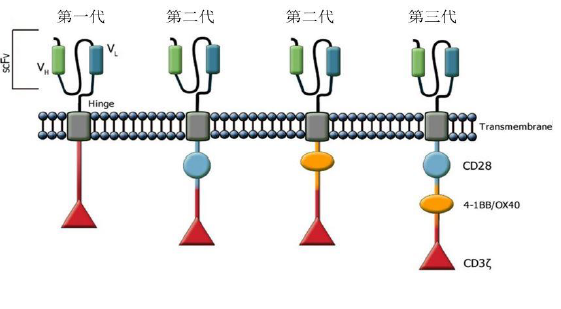
细胞内信号转导区主要为CD3ζ或FcεRIγ含有免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAM,)以及第二刺激信号CD28或者其它分子,4-1BB, OX40等正向协同刺激信号。根据CAR结构的进化,有第一代,第二代和第三代。几代CAR-T的区别在于细胞内信号转到区连入了不同的正向协同刺激信号:第一代CAR(左)由单链抗体通过跨膜区域与胞内信号传导区(ITAM)相连, ITAM通常为CD3ζ或FcεRIγ; 第二代CAR(中)的胞内信号转导区引入了共刺激分子, 主要为CD28 或4-BB; 第三代CAR(右)同时引入了两个共刺激分子, 主要为CD28加上4-BB 或OX40。早期的实验证明了CAR-T 的可行性,然而第一代CAR 只能引起短暂的T 细胞增殖和较低的细胞因子分泌,不能提供长时间的T 细胞扩增信号和持续的体内抗肿瘤效应。依照T 细胞活化的双信号学说,T 细胞的激活和增殖需要两个共刺激信号;第二代、第三代CAR 引入了共刺激分子信号序列,旨在提高T 细胞的细胞毒活性、增殖性与存活时间,并且促进细胞因子的释放。
图6,
CAR-T治疗,简单来说有五步:
1: 从癌症病人身上分离免疫T细胞。
2: 利用基因工程技术给体外的T细胞加入一个能识别肿瘤细胞,
并且同时激活T细胞杀死肿瘤细胞的嵌合抗体,从而使T细胞
变身为CAR-T细胞。
3: 体外培养,大量扩增CAR-T细胞。
4: 把扩增好的CAR-T细胞输回病人体内。
5: 严密监护病人,控制身体的剧烈副反应(见后述)。
图7,CAR-T治疗的流程:
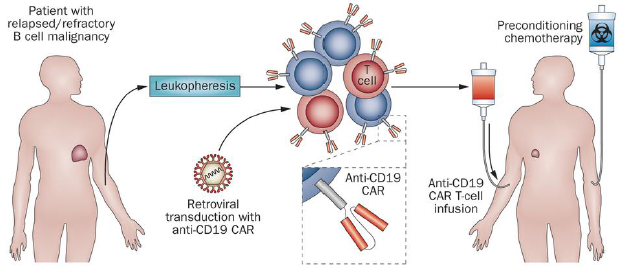
针对CD19、CD20和CD22为靶抗原的CAR-T细胞治疗B细胞恶性肿瘤研究较多, 原因就是即便损伤了成熟B细胞, 也只是暂时的、可恢复的。美国宾州Hershey女孩 ,Emily Whitehead 患有急性淋巴细胞白血病(ALL),治疗靶点为CD19。
图8,
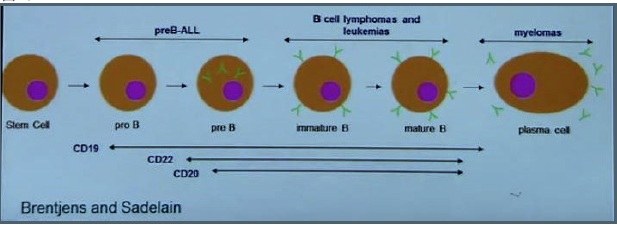
从图8中看出,CD19在pre-B 和 成熟B细胞,包括正常和恶性增殖的B细胞表达, 但是淋巴干细胞和成熟浆细胞没有CD19。带有抗CD19 scFv 的CAR-T 细胞可以攻击pre-B 和成熟B细胞而不伤害淋巴干细胞,保留了淋巴干细胞的再生功能。使用抗CD19的CAR-T细胞进行
治疗,其毒性仅限於B细胞系,B 细胞功能缺陷可通过输入丙种球蛋白来弥补。CAR-T 细胞可以在病人体内持续很长一段时间,5年后今天的Emily Whitehead 体内仍有CAR-T细胞。
CD19靶点的CAR-T临床治疗进展最为突出,在治疗白血病ALL、CLL (Chronic Lymphocytic Leukemia),和NHL(B 细胞non-Hodgkin lymphomas)的领域捷报频传。从2012年到2016年,美国宾州大学教授Carl H. June 用CD19 CAR-T治疗了60个ALL病人,其疗效高达93%。这些ALL患者往往是复发或抗药的,其它治疗方法都已耗尽。截止到2016年5月,Carl H. June 用CD19 CAR-T已经治疗了368 个B淋巴细胞肿瘤病人。
其它研究较多的靶点有Her2、GD2、CEA、mesothelin、BCMA等。需要做更多研究的是;寻找肿瘤特异性更强的抗原,或相同抗原高表达在肿瘤细胞, 低表达在正常细胞。改进CAR-T细胞上scFv抗体的亲和力。设计双功能的CAR-T和自杀开关如引入iCasp9基因等。
CAR-T治疗也面临着临床风险;
1,细胞因子风暴,也叫细胞因子释放综合征。产生的原因是T细胞在杀死其它细胞的时候会释放很多细胞因子如IL-6、INF- 等,它们的作用是激活更多的免疫细胞来一起对抗这些病原体,这种正反馈机制保证了对病原体的快速清除。同时在临床上也引起了剧烈的炎症反应。由于CAR-T杀癌细胞实在是太快太有效了,于是瞬间在局部产生超大量的细胞因子,引起惊人的免疫反应,称为细胞因子风暴。其临床表现;病人超高烧不退,严重时可危及生命。前述CAR-T治疗的最后一步是严密监护病人。女孩Emily Whitehead接受CAR-T治疗的最后,曾经高烧到昏迷不醒,病情危险。幸好后来使用抗IL-6R抗体Tocilizumab, 使她马上转危为安。当然现在临床上经验已经丰富了很多,对细胞因子风暴有了认识并提前准备,控制风险也更有把握了。
2,CAR-T治疗另一毒性是神经毒性。接受治疗的病人会出现脑水肿,并可能因此致死。
CAR-T疗法在白血病治疗的成功激发了投资者的兴趣,大量资金涌入CAR-T 领域,推动了生物产业与研究机构的临床研究合作。2014年6月,只有19名员工的KITE生物技术公司在纳斯达克上市,一天内揽金1亿3千万美!同样不到20人的JUNO生物技术公司2014一年之内成功融资超过3亿,并于当年12月在纳斯达克上市时再次募集了2.65亿美元。这两个小公司没有任何收入,没有一个上市的药物,是因为投资人青睐CAR-T的技术,一个也许能治愈癌症的技术。
宾夕法尼亚大学携手诺华(Novartis);KITE则与NCI合作。2013年,Fred Hutchinson癌症中心、Memorial Sloan Kettering 癌症中心和西雅图儿童医院的科学家联手成立了JUNO。形成了三巨头鼎立的局面。另外,礼来、葛兰素史克、强生、默克也投资介入CAR-T领域。其他的CAR-T研发型企业包括BlueBird、Bellicum、Cellectis等多家也涉足CAR-T疗法。2015年CAR-T研发型企业17家,2016年超过100多家。
2012年,Novartis与宾夕法尼亚大学合作开发基于CD19 靶点的CAR-T技术,斥资2000万美元新建实验室,2014年又斥资2000万美元在宾大医学院建立一个细胞疗法研究中心,成为全球首个综合性CAR-T细胞疗法开发中心。2014 年7 月,其CTL019 获得了FDA的突破性疗法认定,药物研发完毕后享受一切FDA 审批的绿色通道。美国宾州大学教授Carl H. June 的临床试验和Emily 的治疗都是源于Novartis的合作。
Juno Therapeutics (JUNO)则与上述的三家医学机构合作。在2016 6月ASCO上报道的临床研究中,51名复发或难治性(r / r)急性淋巴细胞白血病(ALL)成年患者用环磷酰胺或氟达拉滨/ 环磷酰胺,然后输注JCAR015。随访研究观察到90%的完全缓解率(CR)。然而在同年7月6日,JCAR015在Ⅱ期临床试验中导致2例患者脑水肿死亡而被叫停。JUNO认为是由于CAR-T治疗前用药氟达拉滨引起。但是去除氟达拉滨后继续临床试验,11月23日又出现了三个脑水肿死亡病例,JUNO不得不终止JCAR015临床试验,痛失了在CAR-T的领先地位。JUNO将其重心转向其它产品,JCAR17 和 JCAR14等。它们的区别见图9。
图9, JUNO JACR-14, JCAR-15 和 JCAR17。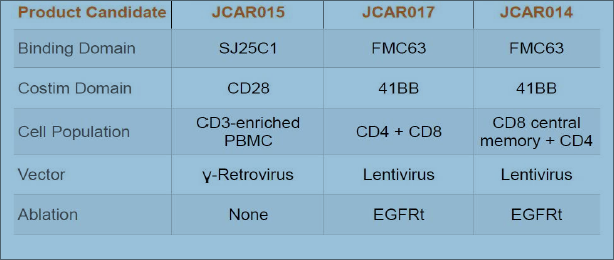
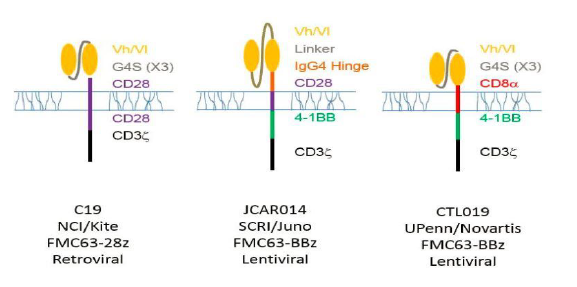
KITE 与美国国家癌症研究所(NCI)建立了广泛的合作关系, 2016年 12月ASH上,KITE公布了其CAR-T疗法KTE-C19-101(ZUMA-1)针对难治性恶性NHL的临床数据。51例DLBCL患者中完全缓解率为47%。KITE 的研发进度原本稍落后于JUNO和Novartis。但是在2016年12月4日,KITE 宣布其领先产品KTE-C19已经启动BLA滚动申报,适应症为B细胞非霍奇金淋巴瘤,从而后来居上。KTE-C19的共刺激分子与JUNO的JCAR15一样为CD28,而不是4-BB。见图10。
图10,
研究人员几十年来一直在努力探索,利用身体免疫系统来对抗肿瘤。这些努力正在取得成效。癌症免疫疗法目前在CAR-T和免疫检查点抑制剂(另文详述)两种不同的技术上,临床治疗获得显著成效。科学杂志的编辑们选择了癌症免疫治疗作为2013年度的重大突破。
从目前CAR-T的临床前实验研究结果和临床应用方面来看,治疗血液癌症,特别是CD19抗原的肿瘤效果很好,但在实体瘤的效果不佳,同时也遇到安全性和治疗后复发等问题。产业化制备也有待于降底治疗的成本。既使这样,CAR-T和免疫检查点抑制剂治疗癌症的免疫疗法已初露曙光。
张克明;2017年3月31日
