CAR-T治疗恶性淋巴瘤里程碑——3项关键临床试验之比较
肿瘤治疗正在进行着革命性的进展。抗原特异性的肿瘤免疫治疗,比如免疫检查点抑制剂和嵌合抗原受体(chimeric antigen receptor,CAR)T细胞疗法,已经为一小部分晚期或复发的肿瘤患者带来长期完全缓解,为治愈肿瘤带来了更多的希望和信心。CAR T CD19对于淋巴细胞白血病的疗效带来了针对不同靶向抗原CAR T的蓬勃发展。据宋永平和刘德龙教授等人的统计分析,截至2017年7月,至少已经有121项来自中国的针对CD19和其他靶点抗原的CAR T临床试验在ClinicalTrials.gov注册。
2017年10月18日,美国FDA批准了axicabtagene ciloleucel用于治疗复发和顽固性高恶性细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤、纵隔细胞淋巴瘤、高恶性淋巴瘤和转化型的弥漫性大B细胞淋巴瘤。这是继2017年8月30日美国FDA批准tisagenlecleucel用于治疗复发和顽固性急性粒细胞性白血病后,癌症免疫治疗,尤其是靶向细胞治疗的又一个里程碑。
ZUMA-1
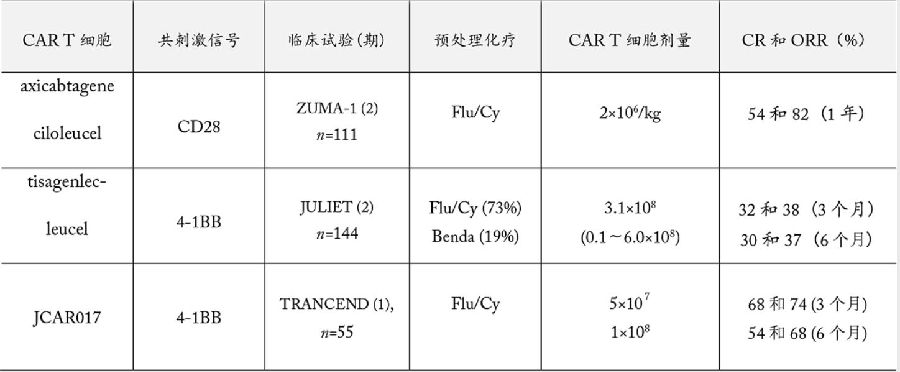
axicabtagene ciloleucel的批准基于发表于2017年12月28日一期《新英格兰医学杂志》(NEJM)(2017年12月10日在线发表)的关键性2期临床试验ZUMA-1。共110名患者入组,这些患者罹患复发或顽固性高恶性淋巴瘤,并且至少已经接受了两种和两种以上的化疗方案。其中,101名接受了治疗。实验结果表明,治疗后12个月患者的完全缓解率为54%,部分缓解率为28%,总缓解率为82%。在平均15.4个月的随访期间,40%的患者继续保持完全缓解。治疗后18个月,患者的总生存率为52%。
ZUMA-1的治疗方案是:预处理低剂量的环磷酰胺和氟达拉滨(Flu/Cy),然后一次性回输 CAR T细胞剂量200万/kg。ZUMA-1的结果显示:①65岁以上患者(年龄最大为76岁)缓解率 为92%,65岁以下患者为79%。②淋巴瘤大于10 cm的缓解率为71%,小于10 cm的为85%③淋巴瘤细胞ABC型的缓解率为76%,GCB型为88%。以下这些因素对缓解率(ORR)的影响没有超过10%:淋巴瘤临床期、IPI预后指标、治疗史、靶点CD19阴性或阳性或CD19表达的高低(需要注意CD19检测方法的敏感性)、CD4/CD8的比例(高或低于1)、托珠单抗(抗IL-6单抗)和地塞米松的使用。
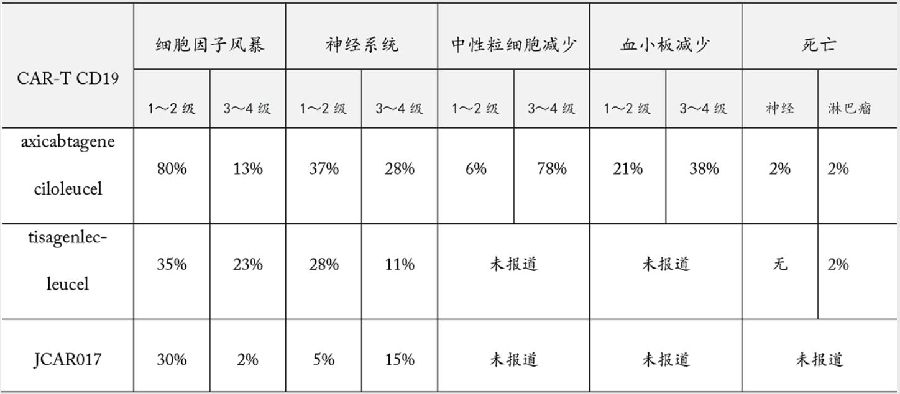
ZUMA-1中,常见的3级和4级的副作用是:中性粒细胞低、贫血、血小板低、感染、细胞因子释放综合征(CRS)、神经系统。4名患者死亡:2名死于淋巴瘤进展,2名死亡时有神经系统并发症。因CRS和神经性副作用,47%的患者需要托珠单抗,27%的患者使用了地塞米松。
主要CD19 CAR-T细胞对高恶性淋巴瘤治疗早期临床试验结果见表1。
表1 主要CD19 CAR-T细胞对高恶性淋巴瘤治疗早期临床试验结果
JULIET
在同一期的NEJM,宾夕法尼亚大学一个回顾性病例系列报告了CTL019/tisagenlecleucel对淋巴瘤的治疗。弥漫性大B细胞淋巴瘤的14名患者有6名(43%)达到了完全缓解。在平均28.6个月的随访期间,86%的患者保持继续缓解。关键性的多国多中心2期临床试验(JULIET)正在测试CTL019/tisagenlecleucel对复发和顽固性恶性B细胞淋巴瘤的治疗效果。
在JULIET的预处理方案中,73%用Flu/Cy,19%用bendamustine。一次性回输CAR T细胞。144名患者入选,99名患者接受了治疗,81名患者在美国。这81名美国患者的试验中期分析在2017年12初的美国血液病年会报告,其结果显示:治疗后3个月,完全缓解率为32%,部分缓解率为6%;治疗后6个月,完全缓解率为30%,部分缓解率为7%。86%的患者有3级和4级副作用;CRS总发生率58%,包括3级15%、4级8%。其他毒性为3级和4级的有:神经系统12%,造血系统27%,重度感染20%。3名患者死于淋巴瘤进展,没有患者直接死于CAR T细胞治疗。因CRS和神经性副作用,15%的患者需要托珠单抗,11%的患者使用了激素。
TRANCEND
Juno的JACR017也是靶向CD19的CAR,以4-1BB为共激活信号。针对复发和顽固性恶性B细胞淋巴瘤,JACR017的早临床试验证明:Flu/Cy预处理的完全缓解率是50%,总缓解率是72%;只用环磷酰胺预处理的完全缓解率只有8%,总缓解率50% [5]。JACR017刚刚发布的1期临床试验TRANSCEND全部采用Flu/Cy预处理方案,测试两个CAR T细胞剂量。第一剂量组5×107或第二剂量组1×108细胞。第二个剂量组3个月后的完全缓解率是68%,总缓解率是78%;6个月后的完全缓解率是54%,总缓解率是68%。JACR017正处于多中心2期关键临床试验治疗中。治疗方案以Flu/Cy为预处理,按患者体重一次性回输 CAR T细胞。严重的细胞因子释放综合征和中枢神经副作用的发生率分别为2%和15%[6]。
主要CD19 CAR T细胞对高恶性淋巴瘤治疗早期临床试验中的主要副作用见表2。
表2 主要CD19 CAR T细胞对高恶性淋巴瘤治疗早期临床试验中的主要副作用
CAR T有望成为弥漫性大B细胞淋巴瘤的二线治疗方案
弥漫性大B细胞淋巴瘤的首选治疗方案是CHOP-R,完全缓解率在80%左右,部分缓解率为15%左右。然而5年内的复发率是40%左右,5~10年仍有5%~10%的复发可能性[7]。15%部分缓解和复发的患者,需要2次化疗,2次化疗的总缓解率只有50%左右,其后可以自体骨髓干细胞移植。自体移植后仍有40%复发。这些复发的患者和那些化疗2次没有缓解的患者,预后非常差,中位总生存期是6.3个月。axicabtagene ciloleucel为这些不幸的患者提供了希望,ZUMA-1的临床试验结果证实了CAR T在淋巴瘤治疗中的作用。
针对弥漫性大B细胞淋巴瘤治疗,CAR T细胞治疗正在从3线或4线走向2线治疗。对第一次复发或对CHOP-R没有完全缓解的弥漫性大B细胞淋巴瘤,自体骨髓移植还是自体CAR T细胞治疗更有效?在不远的未来,就会有答案:ZUMA-7将通过随机分组的3期临床试验,比较自体CAR T细胞治疗和自体骨髓移植的疗效。
ZUMA-1的临床试验,提示我们CAR T细胞疗法的临床应用和效果至少要考虑以下这些因素。
(1)患者:年龄,病史和健康状况(PS)。
(2)肿瘤的临床和病理特性,如淋巴瘤的临床期、IPI预后指标、肿瘤大小(超过10cm)、靶点CD19是阳性还是阴性、淋巴瘤细胞CD19表达的高低。
(3)预处理方案(conditioning regimen):Flu/Cy 有助于 CAR T 细胞的体内扩增,正在成为血液肿瘤治疗的预处理标准。
(4)CAR T细胞:CD4∶CD8相对比例、细胞的用量、回输的时间和次数。
(5)并发症的处理和预防:CRS、中枢神经毒性、托珠单抗和地塞米松的使用。
(6)生物标志物的监测和其对治疗效果与副作用的预测。
ZUMA-1临床试验的成功实施,也为临床应用和推广CAR T细胞治疗提供了参考模型。严格的质量控制,标准化的CAR T生产、运输、储存、回输,对副作用的密切监视和及时的临床处理等环节对患者的安全治疗至关重要。
结语
CAR T细胞治疗是个体化的治疗,需要从每个患者制备,成本高昂。axicabtageneciloleucel制备价格估计是373,000美元,tisagenlecleucel制备价格是475,000美元。加上治疗费用和对副作用的处理,最后的总治疗费用可能在1,000,000~1,500,000美元。随着更多更安全有效的CAR T走入临床,治疗成本能够改善,更多的患者可以受益。
