增强NK细胞持久性和抗肿瘤活性的策略
自然杀伤(NK)细胞是一类独特的天然淋巴样细胞,具有识别和清除病毒感染细胞和肿瘤细胞的固有能力。NK细胞具有多种细胞毒机制和通过细胞因子的产生调节免疫反应的能力,在抗癌免疫中发挥着关键作用。近年来,随着嵌合抗原受体(CAR)工程的过继T细胞疗法的成功,以及将细胞转化为强大的抗肿瘤武器的技术进步,人们对NK细胞作为免疫治疗候选细胞的兴趣呈指数级增长。在临床上,第一代NK细胞疗法取得了令人振奋的结果,显示出了强大的疗效和显著的安全性,从而推动了继续创新的巨大热情。本文就增强NK细胞毒性和持久性的各种策略做一个简单介绍,以指导如何设计下一代NK细胞产品。
01
CAR/TCR工程化NK细胞
嵌合抗原受体(CARs)是一种人工合成的融合蛋白,由胞外抗原识别结构域和胞内信号部分组成,可触发细胞激活。CAR工程T细胞疗法是第一个出现的,并开发了用于免疫肿瘤学应用的各种产品。自那以后,该领域迅速扩大,NK细胞也被整合到基因工程管道中。研究表明, CAR工程化NK细胞可以有效和特异性地靶向肿瘤,同时保持理想的安全性 (图1) 。
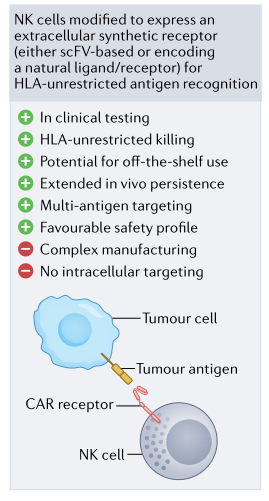
图1. CAR NK细胞示意图
基于CAR的细胞治疗的一个关键障碍是抗原逃逸,这是肿瘤通过抗原丢失或下调来逃避免疫反应的过程。已经采取了各种战略来解决这一问题。靶向多种抗原是一种可行的方法,既可以提高肿瘤检测的严格性,又可以扩大治疗效益(图2)。这通常是通过表达两个单独的CAR(每个CAR针对肿瘤上的不同抗原并连接到两个单独的信号内域)的双顺反子构建体来实现的,或者通过表达包含双特定识别结构域的单个CAR来实现的,每个CAR串联靶向不同的抗原并连接到单个信号内域。
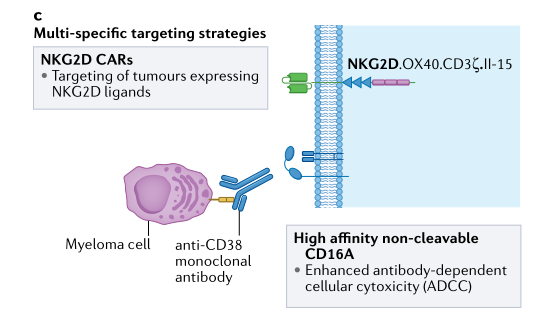
图2.多抗原靶向CAR NK策略
还探索了改进CAR介导的激活控制的策略,特别是将靶上、肿瘤外效应所产生的毒性降至最低。已经通过使用logic-gated CAR策略来促进选择性靶向,被证明可以解决其中的一些问题。在这项工作中,研究小组通过二价CAR靶向AML细胞上的FLT3/CD33,并使用抑制性CAR将抗原结合到健康的造血干细胞(HSCs)上,并诱导出‘NOT signal’以防止细胞杀伤(图3)。
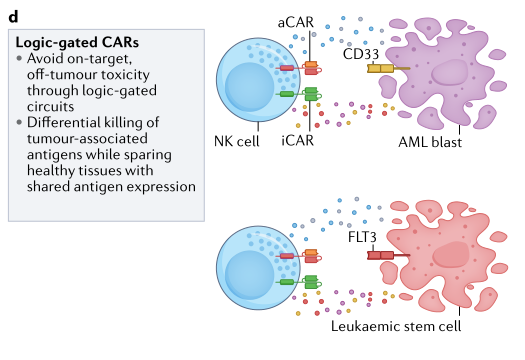
图3. logic-gated CAR策略
基于CAR的方法的另一个关键限制是,在大多数情况下,检测能力仅限于表面蛋白质。细胞内抗原以多肽-人类白细胞抗原复合体的形式存在,通过TCR可以检测到。改造NK细胞表达TCR可以检测到这样的多肽(图4)。TCR引导的NK-92细胞最近被证明介导了成功的抗肿瘤反应。虽然需要更多的研究来验证这种方法的临床适用性,但一个潜在的优势是,因为NK细胞不具有内源性TCR,因而不会出现错配的问题。然而,缺点是NK细胞没有配备T细胞中的完整信号机制,从而潜在地损害了通过合成TCR有效激活的能力。
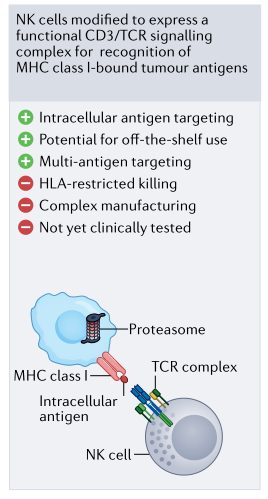
图4. TCR NK细胞示意图
02
NK细胞衔接器
NK细胞也可以通过衔接器被引导到肿瘤部位,通过触发NK细胞上的激活受体,同时将靶抗原结合到肿瘤细胞上,从而引发强大的NK细胞介导的抗肿瘤反应(图5)。其他NK细胞衔接器策略包括三特异性和四特异性抗体设计,旨在通过靶向肿瘤上的多个抗原或通过交叉连接细胞因子部分来支持NK增殖和存活来增强抗肿瘤效果。NK 细胞衔接器的使用绕过了工程化,不需要载体介导的基因转移,因此代表了一种更简单、成本更低的制造工艺,但可以提供CAR-like活性。

图5. NK 细胞衔接器示意图
各种临床前研究表明,当使用NK 细胞衔接器来靶向血液瘤和实体肿瘤时,展现了强大的抗肿瘤功效。例如,最近的研究表明,当通过使用靶向AML上的CLEC12A靶向肿瘤以及人源化的抗CD16单域抗体和IL-15激活NK细胞的三特异性NK 细胞衔接器,NK细胞对原发AML患者来源的AML体内肿瘤模型具有强大抗肿瘤效应(图6)。
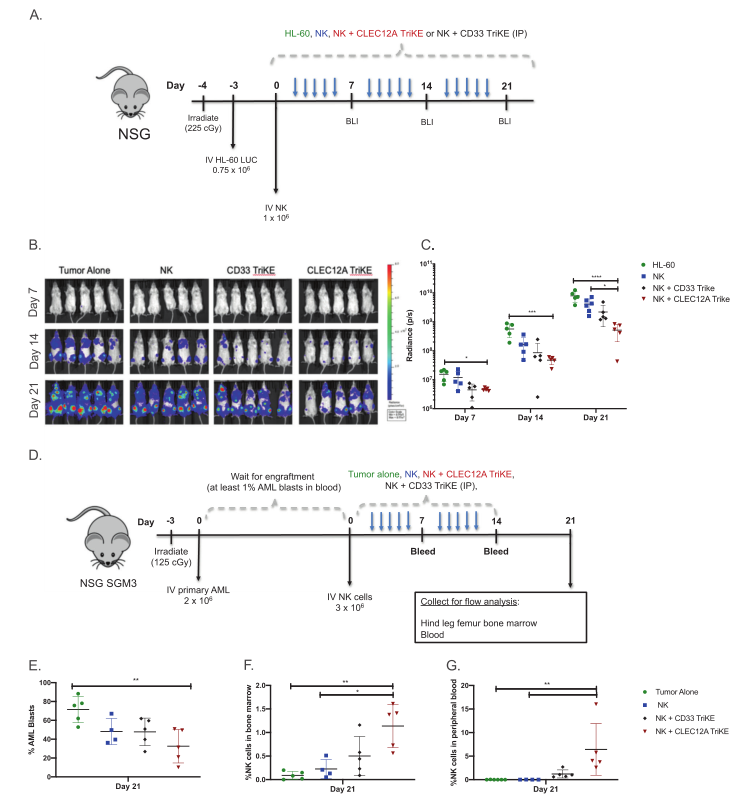
图6. CLEC12ATriKE体内抗肿瘤效果
一些临床试验实验的开展,需要评估这些NK细胞衔接器的抗肿瘤效果的持久性,并确定是否需要多种治疗才能获得持续的治疗效果。
03
细胞因子武装
虽然CAR和TCR工程技术寻求通过基因重定向其特异性来增强NK细胞的功能,但也有一些举措旨在有效地在体外和体内激活NK细胞,以维持最佳的抗肿瘤功能和持久性。众所周知,新分离的NK细胞与已被激活的NK细胞相比,其杀细胞能力较低。解决这一限制的一种方法是细胞因子介导的激活。用IL-2、IL-15和IL-21组合的细胞因子体外扩增NK细胞增强了细胞毒功能、高增殖率,同时保持细胞处于健康、未耗竭的状态。
现在已经很清楚,当在IL-12/15/18存在的情况下培养时,PB-NK细胞可以转变为一种被称为细胞因子诱导的记忆样NK细胞的表型。在移植前和移植后的环境中,细胞因子诱导的记忆样NK细胞在R/R复发性髓系肿瘤患者中都显示出临床疗效。设计记忆样NK细胞来表达CAR可以增强抗肿瘤反应,从而增强对抗NK耐药肿瘤的效力。
尽管这些数据有力地表明了细胞因子激发的优势,但持续的体外刺激会使NK细胞“细胞因子成瘾”,并导致在缺乏体内细胞因子支持的情况下输注这些细胞时其持久性降低。为了避免这个问题,同时仍然利用细胞因子激活的好处,通过基因工程,NK细胞被修饰以产生支持细胞潜能、增殖和持久性的细胞因子(图7)。这种自分泌细胞因子极大的引起了研究人员的兴趣,CAR工程化的NK细胞为了提高其持久性也采用了携带补充细胞因子信号的基因工程化策略。由工程NK细胞产生的细胞因子还可以介导旁观者效应,从而激活存在于肿瘤微环境中的其他免疫效应细胞,如T细胞或髓系细胞,从而潜在地进一步增强抗肿瘤反应。
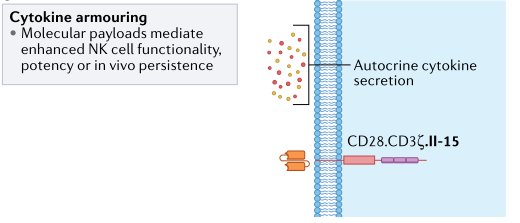
图7. NK细胞细胞因子基因工程修饰
04
克服免疫抑制
TME由复杂和严酷的代谢环境组成,其特征是免疫抑制代谢物、葡萄糖和氨基酸缺乏、低氧和酸性的异质混合。这些因素协同作用阻止了有效的抗肿瘤免疫。特别是在实体肿瘤中,缺氧是免疫细胞功能障碍的常见驱动因素。已有研究表明,缺氧性TME中NK细胞功能受损,部分原因是MDSCs、Treg和M2巨噬细胞在TME中的含量增加,以及缺氧对NK细胞功能的直接影响。据报道,抑制NK细胞中缺氧反应的HIF1a信号可以增强NK细胞的效力,并释放NK细胞介导的抗肿瘤功能。
肿瘤往往表现出异常的代谢行为,导致乳酸水平升高、重要营养物质枯竭以及有毒分解代谢物、腺苷和活性氧类浓度增加。为了克服代谢免疫抑制的有害影响,目前的策略主要集中在两个领域:改变肿瘤的代谢构成或修改免疫细胞中的基因表达程序,以保护它们免受TME中抑制代谢物的影响。当然我们试图调节TME中的免疫代谢时,实现生理平衡是很重要的,因为一些代谢物是正常代谢的重要组成部分。目前许多策略仍在开发中,通过TME调节和NK细胞工程相结合的方法可能会进一步减少免疫抑制。
05
免疫检查点调节
肿瘤已经进化出复杂的机制来逃避免疫监视,包括参与免疫检查点,这可能会以与T细胞类似的方式抑制NK细胞。
抑制性KIR是NK细胞功能的强有力的负性调节因子,当与HLA class I类配体结合时,可以覆盖任何伴随的激活信号。由于其在抑制NK细胞功能中的重要作用,抑制性KIR引起了研究者与制药公司的极大兴趣。Lirilumab是一种panKIR2D抗体,通过阻断这些抑制性KIRs,使NK细胞激活。然而,在两个早期临床试验中,Lirilumab未能引起有临床意义的应答。这些结果的一个潜在原因可能源于抑制性KIR在NK细胞教育和licensing的重要作用。在这一假设下,Lirilumab持续阻断KIRs可能会对NK细胞功能产生负面影响。
与KIR分子类似, NKG2A是另一种重要的负性NK细胞调节因子,当与其同源配体HLAE结合时,可抑制NK细胞的细胞毒作用。Monalizumab破坏了这种相互作用,当与西妥昔单抗联合使用时,在以前治疗过的复发或转移性头颈部鳞状细胞癌患者中产生了的31%的客观应答率。Monalizumab目前正在接受针对其他实体肿瘤的测试,包括结直肠癌和非小细胞肺癌等。
这些方法的共同之处是依赖单抗来调节患者的免疫细胞,然而由于它们在体内的半衰期有限,这一策略需要多次输注。随着基因编辑能力的进步,NK细胞可以稳定地被修饰,以调节增强NK细胞效应器功能。一个例子是抑制受体NKG2A的被遗传破坏,这导致了接种了HLAE+肿瘤的异种移植小鼠模型中的肿瘤控制良好。
06
加强NK细胞对肿瘤的转运
NK细胞运输和穿透肿瘤床的能力是有效抗肿瘤免疫的关键先决条件。与其他免疫细胞类似,NK细胞通过TME分泌的趋化因子受体及其同源配体的动态相互作用而被引导至肿瘤部位。近年来,越来越多的工作研究了如何利用这些相互作用的调节来增强对肿瘤的有效归巢。
早期的研究集中在扩增诱导的趋化因子受体以及瞬时转染法,但由于内化和降解导致趋化因子表达的迅速丧失。这使得研究者通过采用基因工程策略来稳定地为NK细胞配备异位趋化因子受体,如CXCR2、CXCR4等。目前的临床前数据支持趋化因子受体调节可以促进NK细胞在多种难以治疗的肿瘤中的转移,包括多发性骨髓瘤,胶质母细胞瘤,肾细胞癌,胰腺导管腺癌和卵巢癌等。
小结
随着创新药物策略的加速发展和下一代技术的出现,各种NK细胞产品被设计用于癌症治疗。随着该领域的进展,阐明决定NK细胞效力和持久性的关键参数将是重要的,这将有利于我们优化和设计下一代基于NK的治疗药物。
参考文献
1.Natural killer cells in antitumour adoptive cell immunotherapy.
2.A trispecific killer engager molecule against CLEC12A effectively induces NK-cell mediated killing of AML cells.
3.Pluripotent stem cell-derived NK cells with high-affinity noncleavable CD16a mediate improved antitumor activity.
